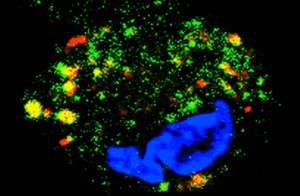
Imagem mostra macrófago infectado com Mycobacterium leprae (em vermelho) durante o silenciamento da expressão do gene OASL. Durante a redução da expressão desse gene, foi observado o direcionamento da bactéria para o autofagossomo (em amarelo), caracterizando um processo importante na eliminação do patógeno e confirmando a importância do OASL na regulação da resposta imune do hospedeiro. (Crédito da foto: Laboratório de Hanseníase do IOC)
Uma doença milenar que ainda tira o sono dos cientistas na tentativa de desvendar seus mistérios, a hanseníase já foi considerada castigo dos deuses e ainda é motivo de estigma e exclusão social. Crendices e preconceitos à parte, a ciência avançou em estratégias de tratamento capazes de garantir cura, mas muitas perguntas ainda precisam de respostas.
Um desses questionamentos busca entender de que forma o Mycobacterium leprae – bactéria causadora da doença – consegue “enganar” o sistema imunológico humano. A pergunta é fundamental, pois, dependendo do resultado do embate entre célula e bactéria, o indivíduo poderá desenvolver a hanseníase – desde pequenas manchas na pele até a limitação dos movimentos, chegando à incapacidade, com restrições de movimentos nas mãos ou nos pés, por exemplo.
Um estudo pioneiro desenvolvido no Instituto Oswaldo Cruz (IOC/Fiocruz) desvendou um dos mecanismos de escape que permite ao bacilo continuar vivo e se replicar nas células humanas. Os cientistas descobriram que, como em um baile de máscaras, o Mycobacterium leprae se disfarça, sendo capaz de provocar reações que seriam comuns em células infectadas por um vírus. Assim, o bacilo de Hansen leva o sistema imunológico a aplicar a estratégia de combate errada. Em consequência, a resposta imunológica do paciente, que deveria protegê-lo de uma infecção por bactéria, fica comprometida.
O resultado inédito – fruto de anos de um trabalho desenvolvido nos Programas de Pós-Graduação Stricto Sensu em Biologia Celular e Molecular e em Biologia Computacional e Sistemas do IOC – acaba de ser publicado no The Journal of Infectious Diseases, importante revista científica internacional voltada para pesquisas sobre doenças infecciosas.
Os pesquisadores demostraram que a infecção por Mycobacterium leprae desencadeia uma série de respostas nas células humanas, sendo uma delas considerada de extrema relevância para a sobrevivência, invasão e ocupação do espaço pela micobactéria: a ativação de alguns genes, estimulados pela produção da citocina Interferon tipo 1. A surpresa é que até pouco tempo atrás o Interferon tipo 1 era conhecido apenas por seu papel na resposta imunológica associada à proteção contra vírus – e, agora, os dados demonstram também sua participação em infecções associadas a um tipo de bactéria.
Um longo processo
A descoberta só foi possível devido a uma extensa cadeia de investigações, iniciada com o estudo desenvolvido por Anna Beatriz Robottom Ferreira durante seu doutoramento no Programa de Pós-Graduação Stricto Sensu em Biologia Computacional e Sistemas do IOC, entre 2007 e 2011. Utilizando uma técnica de análise molecular em larga escala conhecida como microarranjo, Anna Beatriz avaliou a expressão gênica de células de Schwann, componente do sistema nervoso onde o Mycobacterium leprae pode se instalar de forma silenciosa. Dessa maneira, ela identificou que células de Schwann recém-infectadas pela micobactéria apresentaram um perfil de genes diferencialmente expressos associados à ativação da via de Interferon tipo 1.
“Esse é um tipo de resposta observado principalmente quando células são infectadas por vírus. O registro desse tipo de ativação em células infectadas por bactérias intracelulares, como é o caso do Mycobacterium leprae, permanece pouco conhecido, o que nos levou a crer que poderíamos estar nos aproximando de uma importante descoberta”, relembra a ex-aluna.
Orientador de Anna Beatriz, o pesquisador Milton Ozório Moraes, chefe do Laboratório de Hanseníase do IOC, explica que ainda restam perguntas sobre os mecanismos que permitem a invasão celular pela micobactéria e que agem como gatilho para o início da reação imunológica. “O Mycobacterium leprae é a única bactéria que consegue penetrar no nervo, invadindo especialmente as células de Schwann e permanecendo ali, de forma silenciosa. A técnica de microarranjo nos ajudou a começar a entender todo esse processo”, afirma.
O estudo identificou, ainda, que a expressão do gene OASL, também relevante em infecções virais, estava presente no processo de ativação do Interferon tipo 1. Ao ativar essa molécula, o Mycobacterium leprae desvia a atenção das células de defesa: deixa de ser enxergada como uma bactéria e, sim, como um vírus, prejudicando as estratégias de defesa do corpo humano, que acaba confundindo o alvo a ser combatido.
Mecanismo de sobrevivência confirmado
Para desvendar a identidade “por trás da máscara”, faltavam alguns passos. Era necessário comprovar a hipótese de que o gene OASL pudesse ter relevância na sobrevivência da bactéria que causa a hanseníase. Nesse momento, entrou no percurso o biólogo Thiago Gomes Toledo-Pinto, estudante de doutorado no Programa de Pós-Graduação Stricto Sensu em Biologia Celular e Molecular do Instituto Oswaldo Cruz. Ele investigou se a indução da produção de Interferon tipo 1 atuaria como um mecanismo de sobrevivência do Mycobacterium leprae em macrófagos humanos, outro tipo celular preferencial para a infecção pelo bacilo.
Nessa etapa da pesquisa, a expressão do gene OASL foi silenciada (desligada) durante a infecção dos macrófagos. “A experiência comprovou que a ideia de que a presença de OASL após a infecção favorecia a sobrevivência da bactéria, enquanto sua ausência resultou na redução da viabilidade intracelular do Mycobacterium leprae”, comemora Thiago. Esse estágio do estudo estava ainda associado ao aumento da autofagia, um importante processo do hospedeiro para eliminação das bactérias.
Para Milton Ozório Moraes, que também orienta o estudante, os dados sugerem que a ativação da produção de Interferon tipo 1 é, de fato, capaz de inibir a resposta protetora do hospedeiro contra micobactérias, criando um ambiente favorável para a sobrevivência do Mycobacterium leprae nas células humanas. “Esse resultado representa um grande avanço para a ciência na área da hanseníase. Os dados gerados a partir desse estudo podem contribuir para o desenvolvimento de novas estratégias de intervenção terapêutica, uma vez que descobrimos que o sucesso da infecção está estritamente ligado à indução de produção de OASL”, antecipa o pesquisador.
O mecanismo de ativação da produção de Interferon tipo 1 pelo bacilo vem se somar a uma série de estratégias já conhecidas da micobactéria para permanecer viva, incluindo a inibição do processo natural de morte celular, conhecido como apoptose.
Nas próximas etapas da pesquisa, os pesquisadores pretendem ir além: o objetivo é caracterizar, de forma mais específica, o papel desempenhado pelo gene OASL na persistência e replicação intracelular de Mycobacterium leprae. Para isso, vão investigar as etapas da ativação de OASL, para entender melhor os mecanismos que envolvem essa molécula na regulação da resposta a micobactérias.
Fonte: Fiocruz




